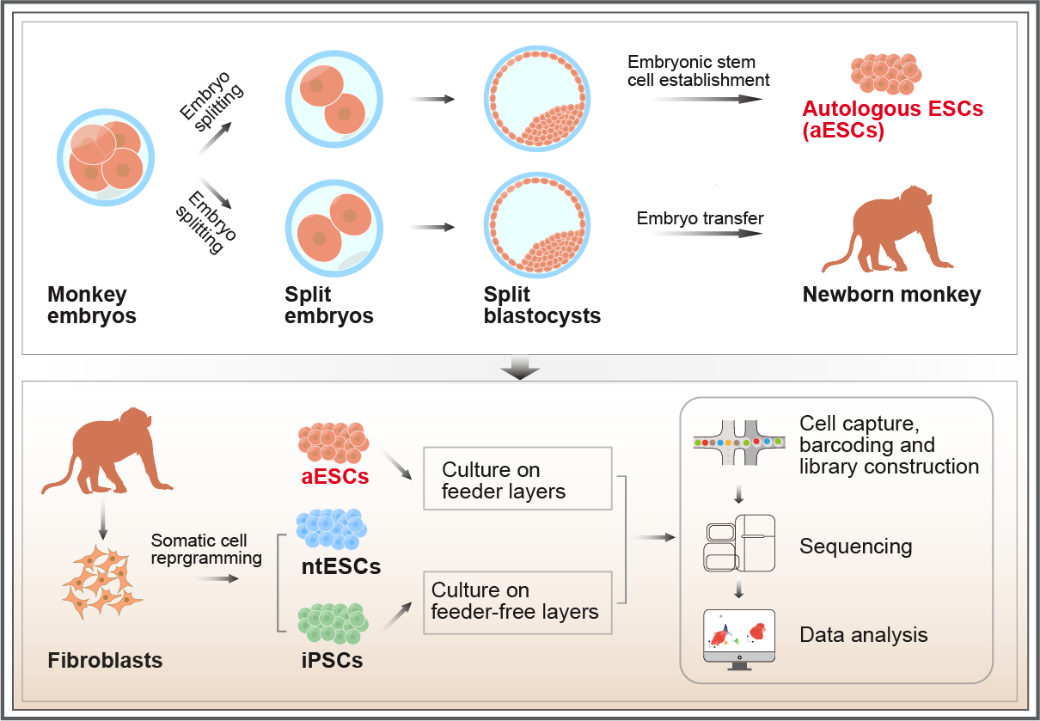
7月1日,昆明理工大学灵长类转化医学研究院/省部共建非人灵长类生物医学国家重点实验室、生命科学与技术学院和西南联合研究生院牛昱宇/代绍兴/季维智团队合作在《Nature Communications》杂志上发表了题为“Production of live monkeys and their genetically matched embryonic stem cells from single embryos”的研究论文。该研究首次利用胚胎分割技术在维持猴胚胎发育潜能的同时,成功获得3只健康猴及其遗传背景匹配的自体胚胎干细胞(autologous embryonic stem cells, aESCs)。且从同一只猴建立了遗传背景一致的诱导多能干细胞(induced pluripotent stem cells, iPSCs)和体细胞核移植胚胎干细胞(nuclear transfer embryonic stem cells, ntESCs),首次获得遗传背景完全一致的灵长类ESCs、iPSCs和ntESCs。单细胞转录组分析揭示,相比iPSCs和ntESCs,aESCs可能具有更低的细胞异质性、转录噪音和更高的基因组稳定性。

体细胞重编程(如诱导重编程、化学重编程和核移植重编程)可获得遗传背景匹配的多能干细胞(iPSCs, ntESCs),用于再生医学可降低排斥风险,但重编程过程不可避免的增加了潜在的突变压力和表观异常风险。胚胎干细胞(embryonic stem cells, ESCs)直接来自于囊胚的内细胞团,并不经历重编程过程,在表观遗传特征上更加接近自然发育状态,但获取涉及整个胚胎,存在伦理问题。如何在保留胚胎发育潜能的同时获得遗传背景匹配的ESCs?这面临技术伦理挑战。
胚胎分割技术模拟自然同卵多胞胎形成过程,将单个胚胎分割为多个遗传匹配的胚胎。该技术在非人灵长类效率低1, 2,人类应用数据有限3。研究团队优化了分割策略:在4细胞期(2:2)和8细胞期(3:5)构建分割胚胎。分割胚胎囊胚率、发育时序和谱系标志物表达与对照相当,可同效率产生活体后代或建立ESCs(称为aESCs)。4细胞期2:2方案中,22对分割胚胎产出1只健康猴及其aESCs。分析发现同一胚胎的两个分割胚胎上胚层细胞数差异显著,可能影响aESC效率。团队进而采用8细胞期3:5策略:细胞多的胚胎用于移植,细胞少的用于建立aESCs。此方案从23对分割胚胎中获得2只健康猴及其aESCs(另1例孕中期终止后建立aESCs)。
随后团队从其中一只猴获得遗传背景匹配的iPSCs和ntESCs。这使团队能最大程度排除遗传背景干扰4-6,多维度比较三种干细胞。不同培养条件下单细胞转录组分析显示:有饲养层时,iPSCs转录异质性较高,暗示较强分化趋向,而aESCs和ntESCs更相似;无饲养层时,三者异质性均降低。相比iPSCs和ntESCs,aESCs转录组噪音更低,基因组稳定性相关基因表达更显著。这表明aESCs在细胞异质性、转录组和基因组稳定性上可能优于iPSCs。考虑到胚胎分割与核移植在伦理和技术上的差异,aESCs在展现ESCs特征的同时,相比ntESCs具有技术优势。当然,系统评估三者差异,尤其是体内功能表现,仍需更多研究。此外,团队还在人类辅助生殖胚胎上成功建立了分割来源的ESCs,展示了建立人类自体胚胎干细胞的潜力。aESCs能否用于治疗,很大程度上取决于建系效率,特别是从少量细胞建系的可行性7, 8。
综上,本研究不仅开创了从分割胚胎生成自体多能干细胞(aESCs)的新方法,还揭示了aESCs相较于iPSCs和ntESCs的可能潜在优势。并为aESCs 在人类再生医学中的进一步应用提供了理论基础和研究模型。
昆明理工大学灵长类转化医学研究院牛昱宇教授、代绍兴教授和季维智院士为该研究的共同通讯作者。司晨洋副教授、博士研究生朱然、吴俊模博士、陈枕枕博士为该研究的共同第一作者。该研究得到中国人民解放军总医院第五医学中心公彦栋副研究员;昆明理工大学灵长类转化医学研究院艾宗勇研究员、尹宇副教授;昆明理工大学灵长类转化医学研究院遗传工程平台、先进影像平台、生物信息大数据平台和实验动物中心的大力帮助。研究受到国家重点研发计划和国家自然科学基金等项目的资助。
原文链接:https://www.nature.com/articles/s41467-025-60694-5
Chan, A.W., T. Dominko, C.M. Luetjens, E. Neuber, C. Martinovich, et al., Clonal propagation of primate offspring by embryo splitting. Science 287, 317-9 (2000).
Mitalipov, S.M., R.R. Yeoman, H.C. Kuo, and D.P. Wolf, Monozygotic twinning in rhesus monkeys by manipulation of in vitro-derived embryos. Biol Reprod 66, 1449-55 (2002).
Noli, L., Y. Dajani, A. Capalbo, J. Bvumbe, L. Rienzi, et al., Developmental clock compromises human twin model created by embryo splitting. Hum Reprod 30, 2774-84 (2015).
Choi, J., S. Lee, W. Mallard, K. Clement, G.M. Tagliazucchi, et al., A comparison of genetically matched cell lines reveals the equivalence of human iPSCs and ESCs. Nat Biotechnol 33, 1173-81 (2015).
Zhao, M.T., H. Chen, Q. Liu, N.Y. Shao, N. Sayed, et al., Molecular and functional resemblance of differentiated cells derived from isogenic human iPSCs and SCNT-derived ESCs. Proc Natl Acad Sci U S A 114, E11111-E11120 (2017).
Kilpinen, H., A. Goncalves, A. Leha, V. Afzal, K. Alasoo, et al., Common genetic variation drives molecular heterogeneity in human iPSCs. Nature 546, 370-375 (2017).
Klimanskaya, I., Y. Chung, S. Becker, S.J. Lu, and R. Lanza, Human embryonic stem cell lines derived from single blastomeres. Nature 444, 481-5 (2006).
Chung, Y., I. Klimanskaya, S. Becker, T. Li, M. Maserati, et al., Human embryonic stem cell lines generated without embryo destruction. Cell Stem Cell 2, 113-7 (2008).
(供稿:灵长类转化医学研究院)
 滇公网安备53011402000430号 All Rights Reserved © Kunming University of Science and Technology
滇公网安备53011402000430号 All Rights Reserved © Kunming University of Science and Technology